H2SO4 có phải là axit không? Khám phá tính chất hóa học, mức độ mạnh yếu, ứng dụng và những sự thật quan trọng về axit sunfuric mà bạn cần biết.
Trong ngành công nghiệp hóa chất, Axit Sulfuric (H2SO4) được mệnh danh là "vua của các loại hóa chất" nhờ vai trò không thể thiếu trong vô số quy trình sản xuất. Tuy nhiên, đối với nhiều người, câu hỏi tưởng chừng đơn giản "H2SO4 có phải là axit không?" vẫn là một thắc mắc cần được giải đáp rõ ràng. Bài viết này từ Hóa Chất Đắc Khang sẽ cung cấp câu trả lời khoa học, toàn diện về bản chất, tính chất, ứng dụng và các biện pháp an toàn khi làm việc với axit sulfuric, giúp mọi người hiểu đúng và sử dụng hiệu quả hóa chất nền tảng này.
1. H2SO4 có phải là axit không?

H2SO4 có phải axit không
Câu trả lời là: Chắc chắn có. Axit sunfuric (H2SO4) không chỉ là một axit mà còn là một trong những axit vô cơ mạnh và quan trọng bậc nhất trong hóa học hiện đại cũng như trong sản xuất công nghiệp. Việc thắc mắc H2SO4 là axit hay bazo là điều dễ hiểu, nhưng về mặt khoa học, bản chất axit của nó là không thể bàn cãi.
Theo định nghĩa kinh điển của Arrhenius, một axit là chất khi hòa tan trong nước sẽ phân ly tạo ra ion hydro (H+). Axit sunfuric hoàn toàn thỏa mãn định nghĩa này. Khi hòa tan trong nước, H2SO4 phân li mạnh mẽ, giải phóng ion H+, nguyên nhân gây ra tính axit đặc trưng.
-
Nấc 1 (phân ly hoàn toàn): H₂SO₄(aq) → H⁺(aq) + HSO₄⁻(aq)
-
Nấc 2 (phân ly một phần): HSO₄⁻(aq) ⇌ H⁺(aq) + SO₄²⁻(aq)
Sự hiện diện của ion H+ tự do trong dung dịch chính là lời giải đáp cơ bản nhất cho câu hỏi H2SO4 có phải là axit không.
Xem thêm: H₂SO₄ Là Axit Hay Bazơ? Giải Thích Dễ Hiểu & Chính Xác Nhất
2. Phân tích chuyên sâu về tính axit của H2SO4

Một số phân tích chuyên sâu về tính axit của H2SO4
Để hiểu rõ hơn về tính axit của H2SO4, chúng ta cần xem xét nó dưới nhiều góc độ lý thuyết hóa học khác nhau.
2.1. Theo định nghĩa axit của Arrhenius
Như đã đề cập, thuyết Arrhenius tập trung vào sự phân ly trong môi trường nước. Axit sulfuric là một ví dụ điển hình:
-
Phương trình phân ly nấc 1: H₂SO₄ + H₂O → H₃O⁺ + HSO₄⁻
- Sự phân ly này xảy ra gần như 100%, biến H2SO4 thành một axit mạnh ngay lập tức.
-
Phương trình phân ly nấc 2: HSO₄⁻ + H₂O ⇌ H₃O⁺ + SO₄²⁻
Nấc thứ hai là một cân bằng động, nghĩa là ion HSO₄⁻ là một axit yếu hơn, nhưng vẫn đóng góp vào nồng độ ion H+ tổng thể trong dung dịch.
2.2. Theo định nghĩa axit của Brønsted-Lowry
Thuyết Brønsted-Lowry mở rộng khái niệm axit là một chất có khả năng cho proton (H+). Axit sulfuric thể hiện rất rõ vai trò này. Trong phản ứng với nước, mỗi phân tử H2SO4 nhường một proton cho phân tử nước, tạo thành ion hydroni (H₃O⁺).
Ví dụ: H₂SO₄ (chất cho proton) + H₂O (chất nhận proton) → HSO₄⁻ + H₃O⁺
Phản ứng này cho thấy H2SO4 hoạt động như một axit Brønsted-Lowry điển hình.
2.3. Theo định nghĩa axit của Lewis
Theo thuyết Lewis, axit là chất có khả năng nhận một cặp electron. Mặc dù ít được đề cập hơn khi nói về tính axit của H2SO4 trong dung dịch nước, nhưng trong một số phản ứng đặc biệt, nguyên tử Lưu huỳnh (S) trong H2SO4 với số oxi hóa +6 có thể hoạt động như một trung tâm nhận cặp electron, thể hiện bản chất axit Lewis.
2.4. Phân loại H2SO4
Dựa trên các tính chất, axit sunfuric được phân loại như sau:
-
Axit mạnh: Độ mạnh của axit được đo bằng hằng số phân ly axit (Ka). Đối với nấc phân ly đầu tiên của H2SO4, giá trị Ka1 là rất lớn (thường được coi là vô cùng), khẳng định đây là một axit cực mạnh. Ở nấc thứ hai, Ka2 ≈ 1.2 x 10⁻², cho thấy ion HSO₄⁻ là một axit có độ mạnh trung bình. Việc xác định H2SO4 là axit mạnh hay yếu phụ thuộc vào nấc phân ly, nhưng nhìn chung nó được công nhận là một axit mạnh.
-
Axit vô cơ: H2SO4 không chứa liên kết cacbon-hydro trong cấu trúc chính, do đó nó thuộc nhóm axit vô cơ.
-
Axit hai nấc (Diprotic Acid): Vì có khả năng cho đi hai proton trong hai giai đoạn phân ly, H2SO4 được gọi là axit hai nấc.
Xem thêm: Cách Nhận Biết H2SO4 An Toàn và Chính Xác Bằng Các Phương Pháp Hóa Học
3. Các tính chất hóa học nổi bật của Axit Sunfuric (H2SO4)

Các tính chất hóa học nổi bật của Axit Sunfuric
Ngoài tính axit của H2SO4, hóa chất này còn sở hữu nhiều đặc tính quan trọng khác, phụ thuộc lớn vào nồng độ của nó.
3.1. Tính axit mạnh (H2SO4 loãng)
Dung dịch H2SO4 loãng thể hiện đầy đủ các tính chất của một axit mạnh thông thường:
-
Tác dụng với kim loại đứng trước Hydro: Giải phóng khí H₂. Ví dụ cụ thể: Sắt (Fe) phản ứng với H2SO4 loãng tạo thành sắt(II) sulfat và khí hydro: Fe + H₂SO₄(loãng) → FeSO₄ + H₂↑
-
Tác dụng với oxit bazơ: Tạo muối và nước. Ví dụ cụ thể: Đồng(II) oxit (CuO) màu đen tan trong dung dịch H2SO4 loãng tạo thành dung dịch đồng(II) sulfat màu xanh lam: CuO + H₂SO₄ → CuSO₄ + H₂O
-
Tác dụng với bazơ: Phản ứng trung hòa tạo muối và nước. Ví dụ cụ thể: NaOH + H₂SO₄ → Na₂SO₄ + H₂O
-
Tác dụng với muối: Tạo muối mới và axit mới, thường có kết tủa. Ví dụ cụ thể: Phản ứng tạo kết tủa trắng bari sulfat (BaSO₄) không tan trong axit: BaCl₂ + H₂SO₄ → BaSO₄↓ + 2HCl
3.2. Tính oxi hóa mạnh (H2SO4 đặc, nóng)
Khi ở dạng đặc và được đun nóng, H2SO4 đặc thể hiện tính oxi hóa cực mạnh, khác biệt hoàn toàn với dạng loãng.
-
Tác dụng với kim loại (kể cả kim loại yếu đứng sau Hydro): Đồng (Cu) không phản ứng với H2SO4 loãng nhưng bị oxi hóa bởi H2SO4 đặc, nóng, tạo ra khí SO₂ có mùi hắc: Cu + 2H₂SO₄(đặc, nóng) → CuSO₄ + SO₂↑ + 2H₂O
-
Tác dụng với phi kim: Cacbon (C) bị oxi hóa thành khí CO₂: C + 2H₂SO₄(đặc, nóng) → CO₂↑ + 2SO₂↑ + 2H₂O
3.3. Tính háo nước (H2SO4 đặc)
H2SO4 đặc có khả năng hút ẩm cực kỳ mạnh mẽ. Nó không chỉ hút hơi ẩm từ không khí mà còn có thể lấy đi các nguyên tử hydro và oxy (theo tỷ lệ của nước) từ các hợp chất hữu cơ.
Phản ứng than hóa đường saccarozơ. Khi nhỏ H2SO4 đặc vào đường (C₁₂H₂₂O₁₁), axit sẽ lấy đi 11 phân tử nước, để lại một khối cacbon màu đen xốp, phồng lên: C₁₂H₂₂O₁₁ --(H₂SO₄ đặc)--> 12C + 11H₂O. Tính chất này được ứng dụng để làm khô nhiều loại khí không phản ứng với axit.
3.4. Các tính chất vật lý quan trọng
- Là chất lỏng sánh như dầu, không màu, không bay hơi.
- Có khối lượng riêng lớn (khoảng 1.83 g/cm³ ở dạng 98%).
- Tỏa nhiệt rất mạnh khi pha loãng với nước. Đây là một đặc tính cực kỳ quan trọng về mặt an toàn. Quy tắc bắt buộc là phải cho từ từ axit vào nước và khuấy đều, tuyệt đối không làm ngược lại. Việc đổ nước vào axit sẽ khiến nước sôi đột ngột trên bề mặt axit, gây bắn tóe axit đậm đặc rất nguy hiểm.
4. Ứng dụng quan trọng của Axit Sunfuric trong công nghiệp và đời sống
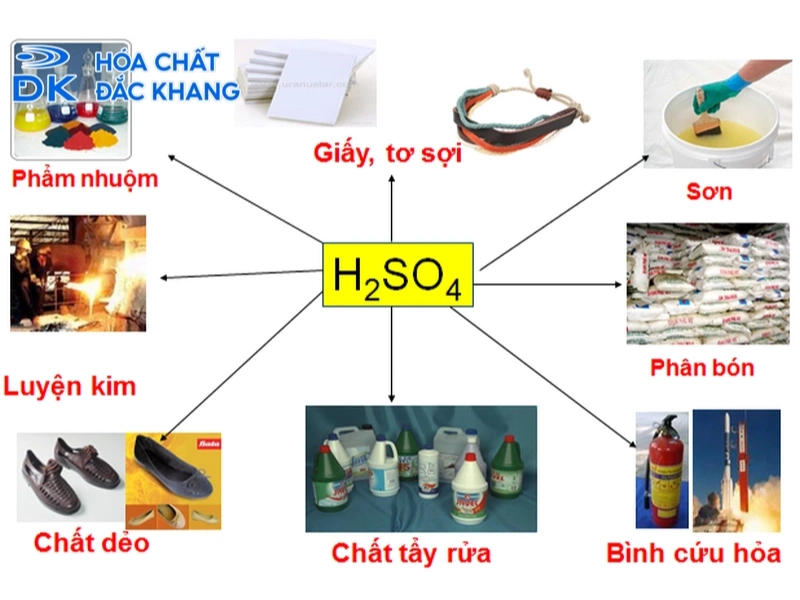
Một số ứng dụng quan trọng của axit sunfuric
Ứng dụng của axit sunfuric vô cùng rộng rãi, là thước đo cho sự phát triển công nghiệp của một quốc gia.
-
Sản xuất phân bón: Đây là lĩnh vực tiêu thụ axit sulfuric lớn nhất. Theo các báo cáo từ ngành hóa chất công nghiệp, lĩnh vực này chiếm khoảng 60% tổng sản lượng H2SO4 toàn cầu. Nó được dùng để sản xuất phân supephotphat và amoni sulfat.
-
Công nghiệp hóa chất: Dùng làm nguyên liệu để sản xuất các axit khác như axit clohydric (HCl), axit nitric (HNO₃), sản xuất thuốc nhuộm, chất tẩy rửa tổng hợp, và tơ sợi hóa học.
-
Ắc quy chì-axit: Axit sulfuric loãng được dùng làm dung dịch điện ly trong hầu hết các loại ắc quy cho ô tô, xe máy và xe nâng.
-
Chế biến dầu mỏ: Dùng để loại bỏ các hợp chất chứa lưu huỳnh và các tạp chất không mong muốn khác ra khỏi xăng, dầu hỏa.
-
Xử lý nước thải: Dùng để điều chỉnh độ pH của nước thải công nghiệp trước khi xả ra môi trường.
-
Các ứng dụng khác: Tính chất của H2SO4 còn được tận dụng trong ngành luyện kim (tẩy gỉ bề mặt thép), sản xuất giấy, dệt may (sản xuất tơ visco).
5. Lưu ý về an toàn khi sử dụng và bảo quản H2SO4

Một số lưu ý an toàn khu sử dụng và bảo quản H2SO4
Hiểu rõ tính chất của H2SO4 đồng nghĩa với việc phải nhận thức được mức độ nguy hiểm và tuân thủ nghiêm ngặt các quy tắc an toàn.
-
Mức độ nguy hiểm: Axit sunfuric là một chất ăn mòn cực mạnh. Tiếp xúc trực tiếp có thể gây bỏng hóa chất sâu và nghiêm trọng cho da, mắt. Hít phải hơi axit có thể làm tổn thương đường hô hấp.
-
Biện pháp phòng ngừa cá nhân (PPE): Luôn trang bị đầy đủ đồ bảo hộ cá nhân khi làm việc với acid sulfuric, bao gồm: kính bảo hộ chống hóa chất, găng tay cao su chịu axit, quần áo bảo hộ hoặc tạp dề chống hóa chất, và ủng. Trong môi trường có nồng độ hơi axit cao, cần sử dụng mặt nạ phòng độc phù hợp. Việc đọc kỹ Bảng dữ liệu an toàn vật liệu (MSDS) do nhà cung cấp đưa ra là yêu cầu bắt buộc.
-
Quy trình xử lý khi tiếp xúc:
- Nếu dính vào da hoặc mắt, phải ngay lập tức rửa vùng bị ảnh hưởng dưới vòi nước sạch chảy liên tục trong ít nhất 15-20 phút.
- Cởi bỏ quần áo bị nhiễm hóa chất.
- Nhanh chóng tìm kiếm sự chăm sóc y tế khẩn cấp.
-
Bảo quản: Lưu trữ axit sunfuric trong các bồn chứa, can, phuy làm bằng vật liệu chuyên dụng (như nhựa HDPE), có dán nhãn cảnh báo nguy hiểm rõ ràng. Khu vực lưu trữ phải khô ráo, thoáng mát, có hệ thống thông gió tốt, tránh xa nguồn nhiệt, các chất dễ cháy, bazơ mạnh và kim loại.
-
Xử lý sự cố tràn đổ: Sử dụng các vật liệu hấp thụ trơ như cát khô, đất hoặc vermiculite để quây và thấm axit. Sau đó, từ từ trung hòa bằng các bazơ yếu như natri bicacbonat (NaHCO₃) hoặc vôi tôi (Ca(OH)₂) trước khi thu gom và xử lý theo quy định.
Qua những phân tích chi tiết trên, Hóa Chất Đắc Khang đã giúp mọi người giải đáp thấu đáo câu hỏi "H2SO4 có phải là axit không?", đồng thời cung cấp một cái nhìn toàn diện về các tính chất, ứng dụng và tầm quan trọng của loại hóa chất này. Việc hiểu biết chính xác bản chất hóa học và các quy tắc an toàn khi sử dụng H2SO4 là yếu tố tiên quyết để khai thác hiệu quả và bảo vệ sức khỏe con người cũng như môi trường. Đối với các doanh nghiệp, nhà máy có nhu cầu sử dụng Axit Sulfuric chất lượng cao, nguồn gốc xuất xứ rõ ràng và được tư vấn an toàn đầy đủ, Hóa Chất Đắc Khang tự hào là đối tác cung cấp uy tín, luôn đặt tiêu chuẩn chất lượng và sự an toàn lên hàng đầu.





