DANH MỤC HÓA CHẤT
H2SO4 loãng có háo nước không? Phân tích khoa học sự khác biệt giữa axit sunfuric loãng và đặc, tính chất – ứng dụng an toàn, chính xác. Xem chi tiết dưới đây!

Là một trong những hóa chất nền tảng của ngành công nghiệp hiện đại, axit sunfuric (H2SO4) sở hữu những tính chất hóa học vô cùng đa dạng. Trong đó, tính háo nước mãnh liệt của H2SO4 đặc là một đặc tính nổi tiếng, nhưng cũng thường dẫn đến sự nhầm lẫn khi áp dụng cho dạng axit loãng. Vậy, câu hỏi cốt lõi đặt ra là: H2SO4 loãng có háo nước không? Bài viết này, dưới góc độ chuyên môn của Hóa Chất Đắc Khang, sẽ cung cấp một câu trả lời khoa học và chính xác, giúp bạn phân biệt rõ ràng tính chất của hai dạng axit này để ứng dụng an toàn và hiệu quả.
 H2SO4 loãng có háo nước không?
H2SO4 loãng có háo nước không?
Chúng tôi xin khẳng định một cách trực tiếp và rõ ràng: H2SO4 loãng không có tính háo nước mạnh mẽ (tức khả năng hút ẩm từ không khí hoặc làm khô các chất khác) như H2SO4 đặc.
Lý do cơ bản nằm ở trạng thái tồn tại của các phân tử. Trong dung dịch axit sunfuric loãng, mỗi phân tử H2SO4 đã được "bao quanh" và tương tác hoàn toàn với một lượng lớn các phân tử nước trong quá trình pha loãng. Các liên kết hydro bền vững đã được hình thành, và các phân tử axit đã ở trạng thái hydrat hóa. Do đó, khả năng "hút" thêm nước từ môi trường bên ngoài của chúng là cực kỳ hạn chế và gần như không đáng kể. Về bản chất, H2SO4 loãng đã bão hòa với nước, nên không còn "khát" nước như dạng đặc.
Xem thêm: Tìm Hiểu Ứng Dụng Của Axit Sunfuric Trong Công Nghiệp
 Phân biệt tính háo nước giữa H2SO4 đặc và H2SO4 loãng
Phân biệt tính háo nước giữa H2SO4 đặc và H2SO4 loãng
Sự khác biệt về nồng độ chính là yếu tố quyết định đến sự khác biệt về tính chất này. Để hiểu sâu sắc, chúng ta cần phân tích cơ chế ở cấp độ phân tử.
Axit sunfuric đặc (thường có nồng độ từ 98% trở lên) thể hiện ái lực mãnh liệt với nước.
Ngược lại hoàn toàn, H2SO4 loãng không thể hiện đặc tính này.
Xem thêm: Nguyên Liệu Sản Xuất H2SO4 Trong Công Nghiệp Phổ Biến Hiện Nay
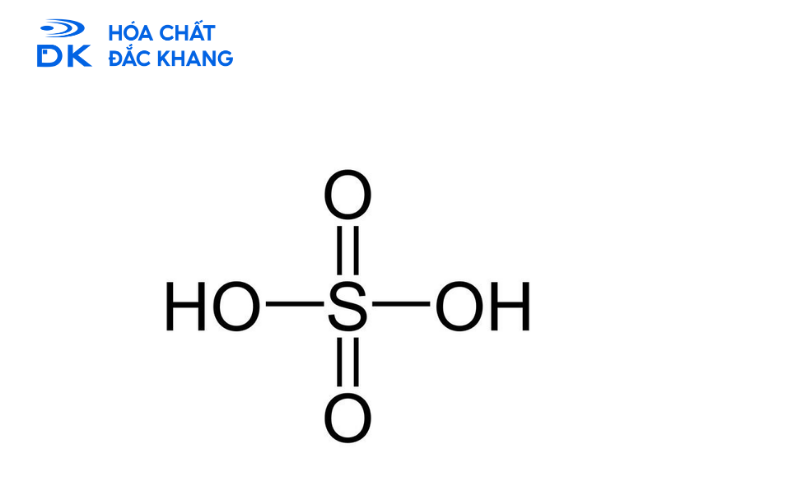 Các tính chất hóa học nổi bật của H2SO4 loãng
Các tính chất hóa học nổi bật của H2SO4 loãng
Khi câu hỏi "H2SO4 loãng có háo nước không" đã được trả lời là không, chúng ta cần tập trung vào các đặc tính thực sự của nó. Axit sunfuric loãng là một trong những axit mạnh phổ biến nhất, thể hiện đầy đủ các tính chất sau:
Đây là một điểm phân biệt H2SO4 đặc và loãng cực kỳ quan trọng. Trong dung dịch loãng, tác nhân oxy hóa là ion H+, chỉ có khả năng oxy hóa các kim loại đứng trước H trong dãy điện hóa. Trong khi đó, H2SO4 đặc, nóng có tác nhân oxy hóa là S+6, có thể oxy hóa hầu hết kim loại (kể cả Cu, Ag) và nhiều phi kim.
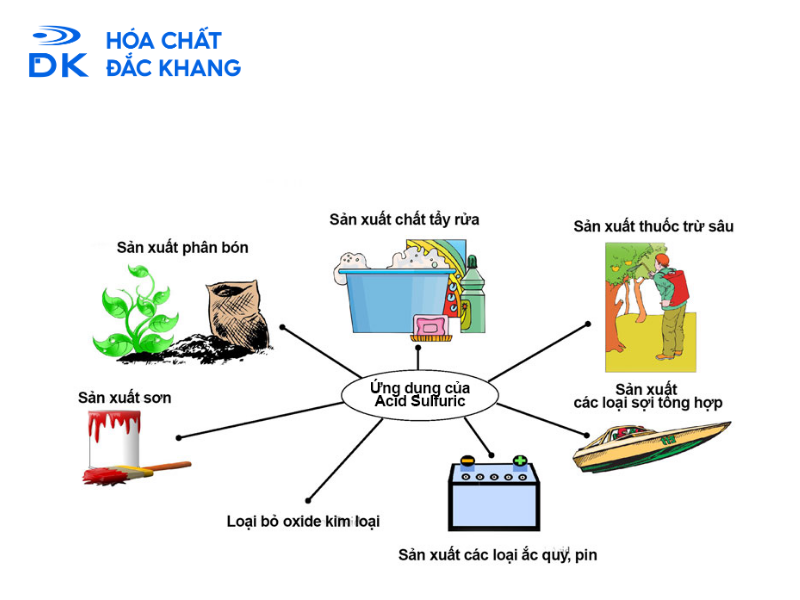 Ứng dụng của H2SO4 loãng trong thực tiễn
Ứng dụng của H2SO4 loãng trong thực tiễn
Nhờ tính axit của H2SO4 loãng rất mạnh và giá thành hợp lý, nó có vô số ứng dụng quan trọng trong công nghiệp và đời sống.
 Mua H2SO4 loãng ở đâu?
Mua H2SO4 loãng ở đâu?
Việc lựa chọn nhà cung cấp uy tín để mua H2SO4 loãng là yếu tố tiên quyết đảm bảo chất lượng sản phẩm và an toàn trong sử dụng. Hóa Chất Đắc Khang, với kinh nghiệm lâu năm trong ngành, tự hào là đơn vị cung cấp các sản phẩm axit sunfuric với nồng độ đa dạng, đáp ứng mọi nhu cầu sản xuất và nghiên cứu của bạn. Chúng tôi cam kết sản phẩm có nguồn gốc rõ ràng, chất lượng ổn định, đi kèm đầy đủ giấy tờ chứng nhận và tư vấn kỹ thuật chuyên nghiệp.
Qua những phân tích chi tiết trên, chúng ta có thể kết luận chắc chắn rằng câu trả lời cho "H2SO4 loãng có háo nước không" là KHÔNG. Tính chất này chỉ đặc trưng cho H2SO4 đặc. Thay vào đó, H2SO4 loãng thể hiện vai trò của một axit mạnh điển hình, là nền tảng cho hàng loạt ứng dụng công nghiệp quan trọng. Hiểu rõ sự khác biệt này là chìa khóa để sử dụng axit sunfuric một cách chính xác, an toàn và tối ưu. Để tìm hiểu thêm về các loại hóa chất công nghiệp khác hoặc cần tư vấn sâu hơn về các ứng dụng cụ thể, bạn vui lòng tham khảo các bài viết khác trên website của Hóa Chất Đắc Khang. Chúng tôi luôn sẵn sàng đồng hành cùng bạn.