DANH MỤC HÓA CHẤT
H₂SO₄ là axit mạnh hay yếu? Bài viết phân tích dựa trên cấu trúc phân tử, mức độ phân ly, tính chất hóa học giúp bạn hiểu rõ bản chất Axit Sulfuric. Xem ngay!

Với vai trò là một trong những hóa chất nền tảng của nền công nghiệp hiện đại, Axit Sulfuric (H₂SO₄) có mặt trong vô số quy trình sản xuất và ứng dụng. Tuy nhiên, chính sự phổ biến này đôi khi lại dẫn đến những thắc mắc cơ bản nhưng vô cùng quan trọng. Một trong những câu hỏi thường gặp nhất mà Hóa Chất Đắc Khang nhận được từ các đối tác là: "H₂SO₄ là axit mạnh hay yếu?". Bài viết chuyên sâu này sẽ cung cấp câu trả lời rõ ràng, dựa trên cơ sở khoa học và các đặc tính thực tiễn, giúp Quý khách hiểu rõ bản chất của hóa chất quan trọng này để sử dụng một cách an toàn và hiệu quả nhất.

H₂SO₄ là axit mạnh hay yếu?
Chúng tôi xin khẳng định một cách trực tiếp và rõ ràng: Axit Sulfuric (H₂SO₄) là một axit mạnh.
Lý do là vì trong dung dịch nước, H₂SO₄ phân ly gần như hoàn toàn ở nấc đầu tiên để giải phóng một lượng lớn ion H⁺ (proton), đây chính là định nghĩa và đặc điểm cốt lõi của một axit mạnh.
Xem thêm: Nguyên Liệu Sản Xuất H2SO4 Trong Công Nghiệp Phổ Biến Hiện Nay
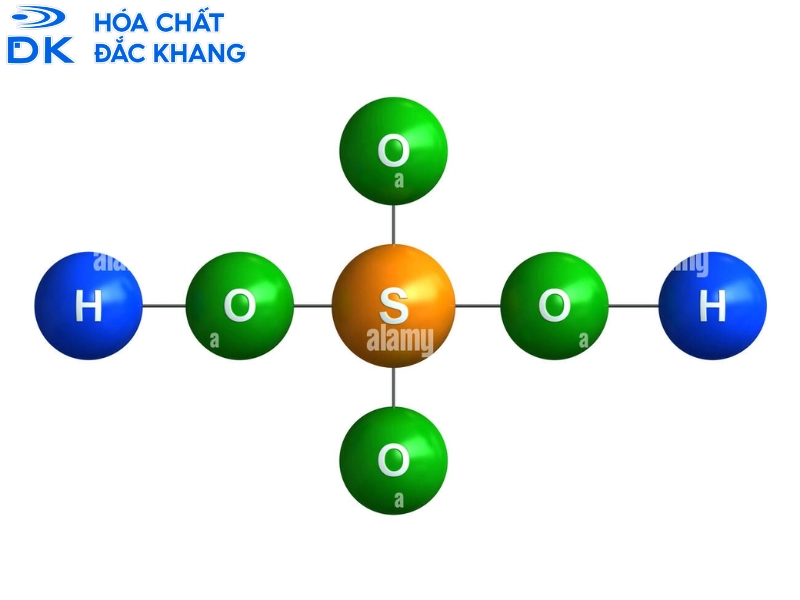
Phân loại axit mạnh, axit yếu
Để hiểu rõ hơn tại sao H₂SO₄ được xếp vào nhóm này, chúng ta cần phân biệt rõ hai khái niệm cơ bản trong hóa học. Tiêu chí chính để phân loại axit mạnh yếu là dựa vào mức độ phân ly trong nước, được thể hiện qua hằng số phân ly axit (Ka).
Xem thêm: Axit Sunfuric Trong Sản Xuất Chất Tẩy Rửa: Vai Trò, Quy Trình và Ứng Dụng Thiết Yếu

Lý do H2SO4 được xếp vào axit mạnh
Việc H₂SO₄ là axit mạnh hay yếu được quyết định bởi cấu trúc phân tử và quá trình phân ly của nó trong môi trường nước.
Phân tử H₂SO₄ có cấu trúc tứ diện, với nguyên tử lưu huỳnh (S) ở trung tâm. Nguyên tử S này liên kết với hai nguyên tử oxy bằng liên kết đôi (S=O) và hai nhóm hydroxyl (-OH). Do độ âm điện rất lớn của các nguyên tử oxy, liên kết O-H trở nên cực kỳ phân cực, làm cho nguyên tử hydro (proton H⁺) rất linh động và dễ dàng bị tách ra.
Axit Sulfuric là một điaxit, nghĩa là nó có thể phân ly qua hai giai đoạn (hai nấc):
Kết luận: Mặc dù giai đoạn phân ly thứ hai là yếu, nhưng vì giai đoạn đầu tiên phân ly hoàn toàn, giải phóng nồng độ H⁺ rất cao trong dung dịch, nên về tổng thể, Axit Sulfuric được công nhận là một axit mạnh.

Các đặc tính quan trọng khác của Axit Sulfuric (H₂SO₄)
Bên cạnh việc là một axit mạnh, H₂SO₄ còn sở hữu nhiều tính chất của H₂SO₄ đặc trưng khác.
H₂SO₄ đặc là một chất oxi hóa rất mạnh, có thể tác dụng với cả những kim loại kém hoạt động và nhiều phi kim.
H₂SO₄ đặc có khả năng hút ẩm cực kỳ mạnh. Nó không chỉ hấp thụ hơi nước từ không khí mà còn có thể tách nước khỏi các hợp chất hữu cơ. Khi tiếp xúc với các chất như đường, giấy hay gỗ, axit sẽ “rút” nước ra khỏi cấu trúc của chúng, tạo ra phản ứng tỏa nhiệt mạnh và để lại carbon đen. Chính tính háo nước này khiến H₂SO₄ đặc đặc biệt nguy hiểm khi tiếp xúc với da, vì nó gây bỏng hóa học sâu và nhanh chóng.
Do các tính chất trên, H₂SO₄ có tính ăn mòn cực mạnh, có thể gây bỏng hóa học nghiêm trọng khi tiếp xúc với da và làm tổn thương mô chỉ trong thời gian rất ngắn. Đồng thời, axit này cũng phá hủy nhanh chóng nhiều loại vật liệu, đặc biệt là các chất hữu cơ, kim loại hoạt động và thậm chí cả một số vật liệu xây dựng, khiến việc bảo quản và sử dụng phải hết sức cẩn trọng.

Ứng dụng của H2SO4
Ứng dụng của H₂SO₄ vô cùng rộng rãi, là chỉ số đánh giá sức mạnh của nền công nghiệp một quốc gia.

Lưu ý khi sử dụng H2SO4
Hiểu rõ an toàn khi sử dụng H₂SO₄ là yêu cầu bắt buộc.
Qua những phân tích chi tiết trên, chúng ta có thể trả lời được câu hỏi “H2SO4 là axit mạnh hay yếu”. Việc hiểu rõ bản chất axit mạnh của nó cùng các đặc tính quan trọng khác là chìa khóa để khai thác tối đa lợi ích mà hóa chất này mang lại, đồng thời đảm bảo an toàn tuyệt đối trong quá trình sản xuất và vận hành. Để đảm bảo chất lượng và an toàn cho quy trình sản xuất của bạn, hãy lựa chọn nhà cung cấp hóa chất uy tín. Hóa Chất Đắc Khang tự hào là đối tác tin cậy, chuyên cung cấp Axit Sulfuric (H₂SO₄) và đa dạng các loại hóa chất công nghiệp khác với chất lượng được kiểm định nghiêm ngặt. Liên hệ với chúng tôi ngay hôm nay để được tư vấn chuyên sâu và nhận báo giá tốt nhất