DANH MỤC HÓA CHẤT
So sánh tính mạnh của axit HCl và H₂SO₄, tìm hiểu sự khác biệt về khả năng ion hóa, tính axit và ứng dụng của từng loại axit trong hóa học

Trong lĩnh vực hóa học, việc so sánh các loại axit mạnh như HCl và H2SO4 luôn là một chủ đề thú vị và quan trọng, đặc biệt khi chúng được ứng dụng rộng rãi trong nhiều ngành công nghiệp. Câu hỏi đặt ra là: "HCl và H2SO4 cái nào mạnh hơn?" Để trả lời câu hỏi này, chúng ta cần phân tích dựa trên các yếu tố như hằng số phân ly (Ka), tính chất hóa học, và ứng dụng thực tế. Hãy cùng Hóa chất Đắc Khang tìm hiểu chi tiết để hiểu rõ hơn về sự khác biệt giữa hai loại axit này!

Để trả lời câu hỏi "HCl và H2SO4 cái nào mạnh hơn?", chúng ta cần xem xét hằng số phân ly axit (Ka) – một yếu tố quan trọng để đánh giá độ mạnh của axit.
Ví dụ minh họa
Dựa trên hằng số phân ly (Ka), H2SO4 mạnh hơn HCl ở nấc phân ly đầu tiên. Tuy nhiên, nếu xét đến nấc phân ly thứ hai, HCl lại mạnh hơn ion HSO4⁻. Điều này cho thấy sự phức tạp trong việc so sánh độ mạnh của hai loại axit này, tùy thuộc vào số nấc phân ly được xét đến.

Mua ngay: Acid Sulfuric H2SO4 98%, Việt Nam, 45kg/Can
Khi so sánh HCl và H2SO4 dựa trên tính chất hóa học, cả hai đều là những hóa chất công nghiệp cực mạnh và có khả năng tham gia vào nhiều phản ứng hóa học quan trọng. Tuy nhiên, chúng có một số điểm khác biệt đáng chú ý:
Cả HCl và H2SO4 đều phản ứng với kim loại, bazơ, oxit bazơ và muối của các axit yếu hơn để tạo ra sản phẩm tương ứng. Đây là đặc điểm chung của các axit mạnh, giúp chúng được ứng dụng rộng rãi trong công nghiệp và phòng thí nghiệm.
H2SO4 đặc, nóng có tính oxi hóa mạnh hơn HCl đặc. Điều này có nghĩa là H2SO4 đặc có khả năng lấy electron từ các chất khác, biến chúng thành các sản phẩm oxi hóa.
Ví dụ: H2SO4 đặc, nóng có thể oxi hóa đồng (Cu), trong khi HCl đặc thì không thể.
Tính oxi hóa mạnh của H2SO4 đặc, nóng giúp nó được sử dụng trong các phản ứng hóa học phức tạp hơn, chẳng hạn như sản xuất hóa chất hoặc xử lý kim loại. Trong khi đó, HCl thường được sử dụng trong các phản ứng thông thường như làm sạch bề mặt kim loại, trung hòa bazơ, hoặc điều chế muối clorua.
Dựa trên tính chất hóa học, cả HCl và H2SO4 đều là những axit mạnh với khả năng phản ứng đa dạng. Tuy nhiên, H2SO4 đặc, nóng vượt trội hơn HCl nhờ tính oxi hóa mạnh, cho phép nó tham gia vào các phản ứng mà HCl không thể thực hiện, như oxi hóa kim loại đồng (Cu). Điều này làm cho H2SO4 trở thành một hóa chất quan trọng hơn trong các ứng dụng công nghiệp phức tạp.
Cả HCl và H2SO4 đều là những axit mạnh, được sử dụng rộng rãi trong công nghiệp và phòng thí nghiệm nhờ tính chất hóa học đặc trưng. Tuy nhiên, mỗi loại axit lại có những ứng dụng khác nhau, phù hợp với từng mục đích cụ thể.
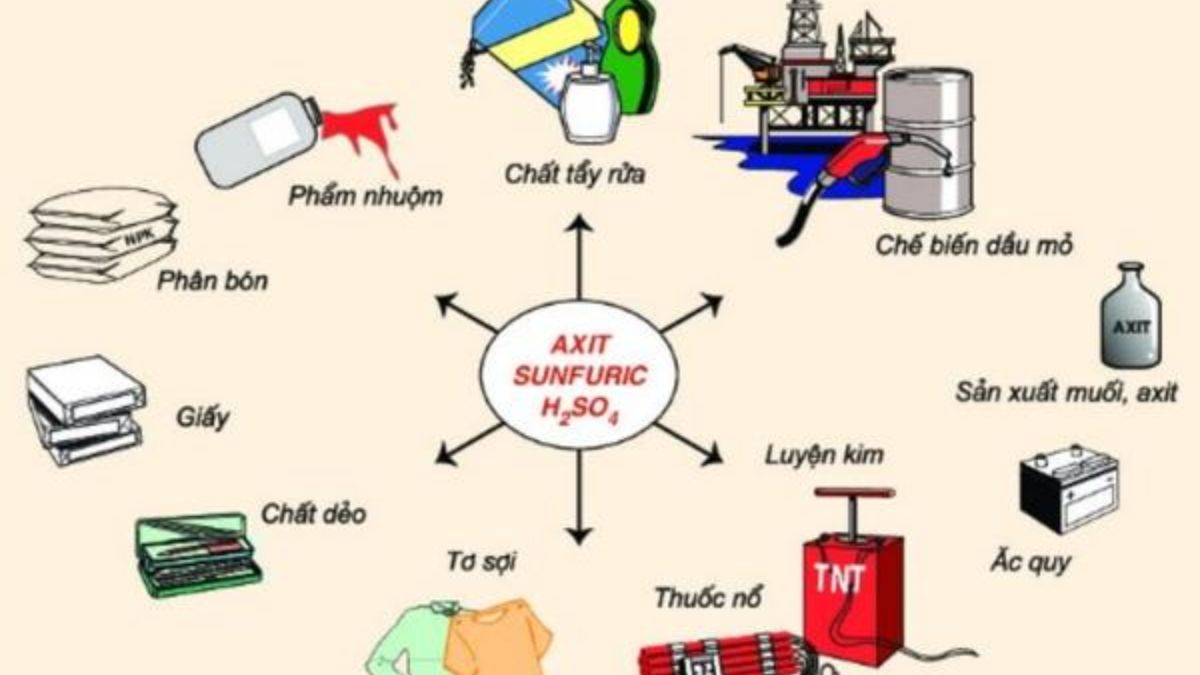
Mua ngay: Acid Clohydric HCl 35%, Việt Nam, 30kg/Can
H2SO4 được coi là một trong những hóa chất công nghiệp quan trọng nhất, với nhiều ứng dụng đa dạng. Một số ứng dụng phổ biến:
Ngoài ra, H2SO4 còn được ưa chuộng nhờ giá thành rẻ hơn so với nhiều loại axit khác, khiến nó trở thành lựa chọn hàng đầu trong các ứng dụng công nghiệp lớn.
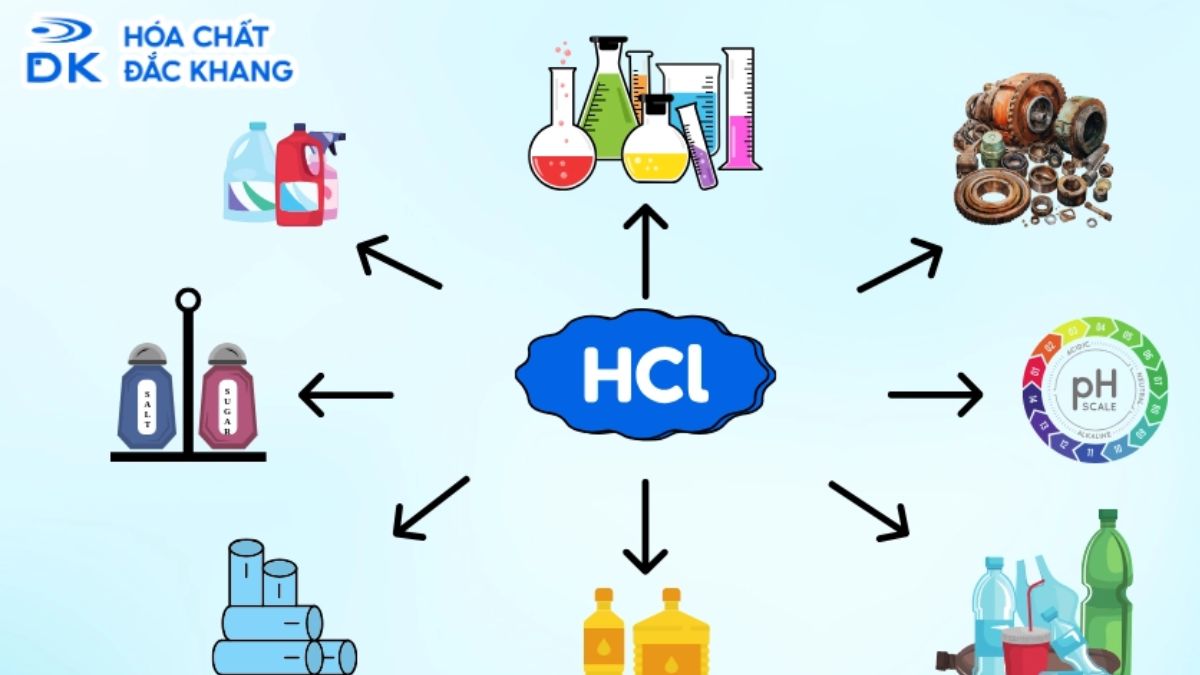
HCl cũng có vai trò quan trọng trong công nghiệp và phòng thí nghiệm, nhưng ứng dụng của nó thường tập trung vào các lĩnh vực cụ thể hơn. Một số ứng dụng phổ biến:
So sánh tổng quan
Dựa trên ứng dụng thực tế, cả H2SO4 và HCl đều đóng vai trò quan trọng trong ngành công nghiệp và đời sống. Tuy nhiên, H2SO4 thường được sử dụng nhiều hơn nhờ tính chất hóa học đa dạng và giá thành rẻ, trong khi HCl lại phù hợp với các ứng dụng chuyên biệt như tẩy rửa kim loại và sản xuất hợp chất hữu cơ clo.
H2SO4 mạnh hơn HCl ở nấc phân ly đầu tiên và thể hiện tính oxi hóa mạnh hơn khi ở trạng thái đặc, nóng. Tuy nhiên, nếu xét cả hai nấc phân ly, ion HSO4⁻ của H2SO4 yếu hơn HCl. Do đó, việc đánh giá H2SO4 và HCl axit nào mạnh hơn cần dựa vào từng khía cạnh cụ thể và mục đích sử dụng.
Tóm lại, việc so sánh HCl và H2SO4 cái nào mạnh hơn phụ thuộc vào cách xét nấc phân ly, tính chất hóa học và ứng dụng thực tế. H2SO4 mạnh hơn HCl ở nấc phân ly đầu tiên và có tính oxi hóa mạnh hơn khi ở trạng thái đặc, nóng, trong khi HCl lại mạnh hơn ở một số khía cạnh khác như tính axit của ion H+. Cả hai axit đều đóng vai trò quan trọng trong công nghiệp và phòng thí nghiệm, với những ứng dụng riêng biệt như H2SO4 trong sản xuất phân bón, ắc quy và HCl trong tẩy rửa kim loại, sản xuất hợp chất hữu cơ clo. Nếu bạn đang tìm kiếm các sản phẩm H2SO4 hoặc HCl chất lượng cao, hãy liên hệ ngay với Hóa chất Đắc Khang – đơn vị cung cấp hóa chất uy tín, luôn đảm bảo chất lượng và sẵn sàng tư vấn để đáp ứng mọi nhu cầu của bạn!