DANH MỤC HÓA CHẤT
NaOH có phải hợp chất ion không? Cùng chuyên gia phân tích cấu trúc, tính chất và bản chất liên kết trong NaOH một cách dễ hiểu và khoa học.
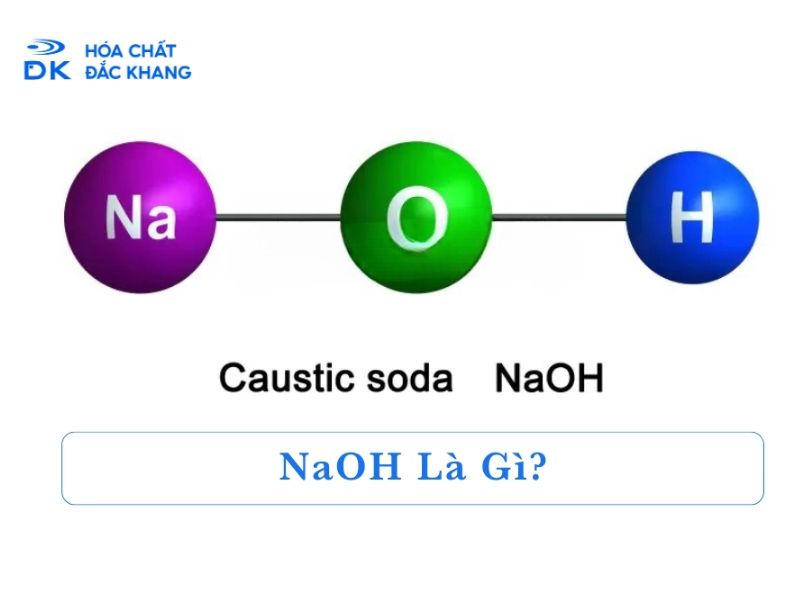
NaOH (Natri Hydroxit) là một hợp chất hóa học quan trọng, được sử dụng rộng rãi trong nhiều ngành công nghiệp và đời sống. Một câu hỏi thường gặp về NaOH là liệu NaOH có phải hợp chất ion không? Bài viết này, được cung cấp bởi các chuyên gia từ Hóa chất Đắc Khang, sẽ đi sâu vào cấu trúc ion của NaOH, các tính chất đặc trưng của ion NaOH và ứng dụng của NaOH từ góc nhìn tính chất ion.

NaOH hình thành từ liên kết ion phải không?
NaOH (Natri Hydroxit) là một hợp chất ion. Để trả lời cho câu hỏi NaOH có phải hợp chất ion không thì chúng ta cần xem xét cấu trúc hóa học và liên kết giữa các nguyên tử trong phân tử NaOH.
Trong phân tử NaOH, chúng ta có ba nguyên tố: Natri (Na), Oxi (O) và Hydro (H). Natri là một kim loại kiềm, trong khi Oxi và Hydro là các phi kim. Khi Natri phản ứng với nhóm Hydroxit (OH), nó sẽ nhường một electron để tạo thành ion dương Natri (Na+). Nhóm Hydroxit (OH) nhận electron này và trở thành ion âm Hydroxit (OH-).
Sự khác biệt về điện tích giữa ion Na+ và ion OH- tạo ra một lực hút tĩnh điện mạnh mẽ giữa chúng. Lực hút này được gọi là liên kết ion, và nó là liên kết chính giữ các ion lại với nhau trong mạng tinh thể NaOH. Vậy có thể xác nhận câu trả lời cho NaOH có phải hợp chất ion không? Là CÓ
Giải thích chi tiết hơn:
Ví dụ:
Tương tự như Natri Clorua (NaCl), hay còn gọi là muối ăn, NaOH cũng là một hợp chất ion. Cả hai đều hình thành từ sự kết hợp giữa một kim loại và một phi kim, tạo ra liên kết ion mạnh mẽ.
Hóa chất Đắc Khang luôn cung cấp các hóa chất chất lượng cao, đảm bảo độ tinh khiết và tuân thủ các tiêu chuẩn kỹ thuật. Việc hiểu rõ bản chất của các hợp chất hóa học giúp chúng ta sử dụng chúng một cách an toàn và hiệu quả hơn.
Xem thêm:
Xút Vảy Trung Quốc - NaOH 99% Uy Tín, Giá Tốt
Xút Vảy Đài Loan - NaOH 98% - Caustic Soda Flakes 25Kg/Bao
Sodium Hydroxide - Xút vảy Ấn Độ, 25kg/Bao
Tìm hiểu cấu trúc NaOH
Cấu trúc ion của NaOH được đặc trưng bởi sự sắp xếp có trật tự của các ion Na+ (ion Natri) và OH- (ion Hydroxit) trong một mạng tinh thể ba chiều. Để hình dung rõ hơn, chúng ta sẽ đi sâu vào các khía cạnh sau:
Cấu trúc ion của NaOH có ảnh hưởng lớn đến các tính chất vật lý và hóa học của nó. Ví dụ, do lực hút tĩnh điện mạnh mẽ giữa các ion, NaOH là một chất rắn ở nhiệt độ phòng, có khả năng tan tốt trong nước (do các phân tử nước có cực có thể tương tác với các ion Na+ và OH-).
Hóa chất Đắc Khang cam kết cung cấp NaOH với độ tinh khiết cao, đảm bảo cấu trúc ion không bị ảnh hưởng bởi các tạp chất. Điều này giúp NaOH phát huy tối đa hiệu quả trong các ứng dụng khác nhau.
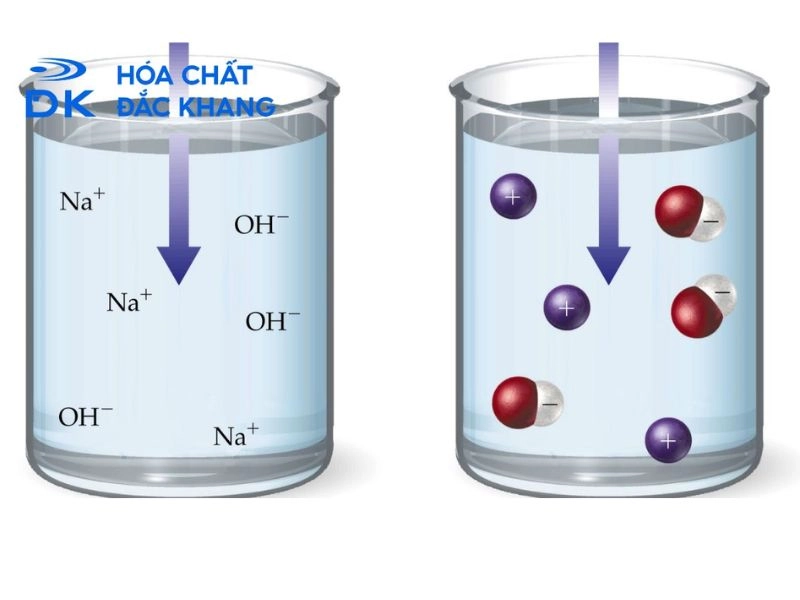
Tính chất nổi bật của NaOH do các ion tạo nên.
Do cấu trúc ion đặc biệt, NaOH sở hữu nhiều tính chất đặc trưng quan trọng, ảnh hưởng đến cách nó tương tác với các chất khác và ứng dụng của nó trong thực tế. Dưới đây là một số tính chất đặc trưng nổi bật của ion NaOH:
Ví dụ:
Khi NaOH phản ứng với axit clohydric (HCl), nó sẽ trung hòa axit và tạo thành muối Natri Clorua (NaCl) và nước (H2O):
NaOH + HCl → NaCl + H2O
Các tính chất đặc trưng của ion NaOH được ứng dụng rộng rãi trong nhiều lĩnh vực, như sản xuất hóa chất, xử lý nước, công nghiệp giấy, dệt nhuộm, và nhiều ngành công nghiệp khác.
Hóa chất Đắc Khang cung cấp NaOH với chất lượng ổn định, đảm bảo các tính chất đặc trưng của sản phẩm được duy trì, giúp khách hàng đạt được hiệu quả tối ưu trong quá trình sử dụng.

Ứng dụng phổ biến của NaOH trong nhiều lĩnh vực
Các ứng dụng rộng rãi của NaOH trong nhiều lĩnh vực khác nhau đều bắt nguồn từ các tính chất ion đặc trưng của nó. Dưới đây là một số ví dụ điển hình:
Ví dụ cụ thể: Trong quá trình xử lý nước thải chứa kim loại nặng, NaOH được thêm vào để nâng độ pH lên mức thích hợp. Khi độ pH tăng lên, các ion kim loại nặng (ví dụ: Pb2+, Cd2+, Hg2+) sẽ phản ứng với các ion OH- tạo thành các hydroxit kim loại không tan (ví dụ: Pb(OH)2, Cd(OH)2, Hg(OH)2). Các hydroxit này sau đó kết tủa và có thể được loại bỏ bằng các phương pháp lắng hoặc lọc.
Hóa chất Đắc Khang cung cấp NaOH chất lượng cao, đáp ứng mọi yêu cầu về ứng dụng trong các ngành công nghiệp khác nhau. Chúng tôi cam kết mang đến những giải pháp hiệu quả và bền vững cho khách hàng.
Từ việc sản xuất xà phòng đến xử lý nước thải, các ứng dụng đa dạng của NaOH đều bắt nguồn từ cấu trúc ion và các tính chất đặc trưng của nó. Hiểu rõ bản chất rằng NaOH có phải hợp chất ion không có thể giúp chúng ta khai thác tối đa tiềm năng của hợp chất này trong nhiều lĩnh vực khác nhau. Hóa chất Đắc Khang tự hào cung cấp NaOH chất lượng cao, ổn định, đáp ứng mọi nhu cầu của quý khách hàng. Hãy liên hệ với chúng tôi để được tư vấn và trải nghiệm những sản phẩm, dịch vụ tốt nhất, góp phần vào sự thành công của doanh nghiệp bạn!